Precipitare (chimie)
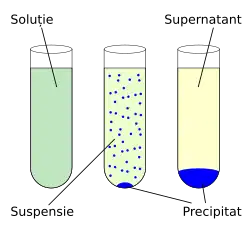
Precipitarea este formarea a unei substanțe greu solubile (solide), numită precipitat, creată într-un mediu lichid de reacție chimică (din soluții suprasaturate) sau prin electroliză. Precipitarea se obține prin adăugare de substanțe precipitante (reactivi) la soluții chimice. Precipitatele au o gamă largă de utilizări în chimia analitică, ele reprezentând caracteristica după care se recunosc anumiți cationi. Reactivii (precipitanții) pot să-și păstreze compoziția chimică în reacție sau să și-o modifice.[1]
Exemple de reactivi
Azotatul de argint
Azotatul de argint AgNO3 este folosit pentru a identifica ionul de clor, rezultand un precipitat alb, brom, rezultand un precipitat galben-pal și iod, rezultand un precipitat galben-pal, dupa reactiile următoare :
Clorura de bariu
Clorura de bariu BaCl2 este folosită pentru recunoașterea ionului de sulfat prin precipitarea sulfatului de bariu, după reacția:
Clorura de bariu BaCl2 este folosită și pentru recunoașterea ionului carbonat, formându-se, analog reacției de mai sus, carbonat de bariu BaCO3, care, precum sulfatul, este un precipitat alb.
Vezi și
- Coprecipitare
- Dizolvare
- Efervescență
- Salifiere
- Sedimentare
- Suspensie (chimie)
Note
- ↑ „Precipitation (Chemical) - an overview”. ScienceDirect. Accesat în .
Bibliografie
- Mică Enciclopedie de Chimie, 1974, Editura Enciclopedică Română