Acid cloric
| Acid cloric | |
 | |
 | |
| Nume IUPAC | Acid cloric |
|---|---|
| Identificare | |
| Număr CAS | 7790-93-4 |
| ChEMBL | CHEMBL1161633 |
| PubChem CID | 19654 |
| Informații generale | |
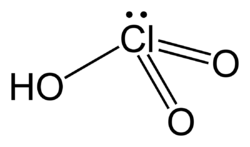
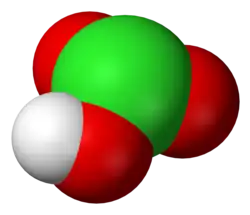
| Formulă chimică | HClO3 |
| Aspect | soluție incoloră |
| Masă molară | 84,459 g/mol |
| Proprietăți | |
| Densitate | 1 g/mL |
| Solubilitate în apă | |
| >40 g/100 ml (20 °C) | |
| Pericol | |
| Fraze R | R8, R34 |
| Fraze S | S17, S26, S36/37/39, S45 |
  | |
| NFPA 704 | |
1
3
2
OX
| |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
Acidul cloric este un acid anorganic al clorului cu formula chimică HClO3. La lumina solară se descompune foarte ușor în acid clorhidric și oxigen, constituind un element principal al apei de clor. Sărurile acestui acid se numesc clorați (exemple sunt cloratul de potasiu și cloratul de sodiu).
Obținere
Acidul cloric poate fi preparat prin reacția dintre acidul sulfuric și cloratul de bariu, iar precipitatul de sulfat de bariu se poate elimina prin filtrare:
- Ba(ClO3)2 + H2SO4 → 2HClO3 + BaSO4
O altă metodă este tratarea acidului hipocloros la temperatură, obținându-se pe lângă acidul cloric și acid clorhidric:
- 3HClO → HClO3 + 2 HCl
Referințe
Bibliografie
- Constantin D. Albu, Maria Brezeanu, Mică enciclopedie de chimie, Editura Enciclopedică Română, 1974, p 17
- Linus Pauling, Chimie generală, Editura Științifică, București, 1972 (traducere din limba engleză), p. 256-257
Acest articol este emis de la Wikipedia. Textul este licențiat sub Creative Commons - Attribution - Sharealike. Se pot aplica termeni suplimentari pentru fișierele media.
