Punct triplu
În termodinamică, se numește punct triplu starea unui corp pur în care fazele gaz, lichid și solid coexistă în echilibru termodinamic. Pe diagrama de fază presiune-temperatură punctul triplu se află la intersecția curbei de echilibru solid-lichid (topire/solidificare) cu curba de echilibru lichid-gaz (condensare/evaporare). Curba de echilibru lichid-gaz începe în punctul triplu și se termină în punctul critic, dincolo de care dispare distincția dintre fazele lichidă și gazoasă; substanța devine un fluid supercritic.
Nu confundați cu Punct critic (termodinamică).
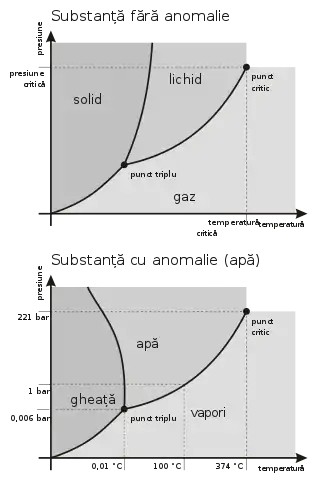
Diagrame de fază presiune-temperatură pentru două substanțe: una fără anomalie de densitate, cealaltă cu anomalie (apă)
Punctul triplu al apei servește la definirea unității de temperatură termodinamică în Sistemul internațional de unități (SI). Kelvinul este definit ca fracțiunea 1/273,16 din temperatura termodinamică a punctului triplu al apei.
Bibliografie
- Enrico Fermi: Thermodynamics, Dover, 1956, pp. 91–94. ISBN-13: 978-0-486-60361-2, ISBN-10: 0-486-60361-X.
- Gregory H. Wannier: Statistical physics, Dover, 1966, pp. 251–255. ISBN 0-48665401-X.
Legături externe
- IUPAC Compendium of Chemical Terminology - the Gold Book (accesat la 11 februarie 2018)
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.