Acid cromic
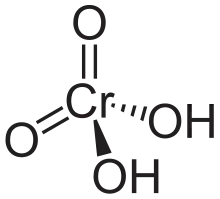
Acidul cromic este un tip special de oxoacid, cu formula chimică H2CrO4, în care atomul central de crom are un număr de oxidare egal cu +6 (VI). Atât acidul, cât și sărurile sale, sunt agenți oxidanți puternici. Formează două tipuri de săruri: cromați (cromat de potasiu) și dicromați (dicromat de potasiu). Anhidrida sa este trioxidul de crom și este un acid slab.[1]
| Acid cromic | |
 | |
| Nume IUPAC | Acid cromic (VI) |
|---|---|
| Identificare | |
| Număr CAS | 7738-94-5 |
| PubChem CID | 24425 |
| Informații generale | |
| Formulă chimică | H2CrO4 |
| Aspect | cristale roșii-brune |
| Masă molară | 118,01 g/mol |
| Proprietăți | |
| Densitate | 1,201 g/cm3 |
| Punct de topire | 197 °C |
| Punct de fierbere | 250 °C |
| Solubilitate în apă | |
| 169 g/100 mL | |
| Pericol | |
| Fraze R | R9, R26, R35, R45, R46, R24/25, R42/43, R48/23 |
| Fraze S | S43, S45, S60, S61 |
    | |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
Obținere
Teoretic, acidul cromic se poate obține prin reacția dintre trioxidul de crom (anhidrida sa) și apă:
De asemenea, mai există și alte metode:
- la fierbere
Proprietăți chimice
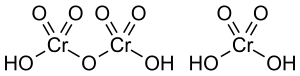
Structura acidului dicromic și a acidului cromic
Acidul cromicse transformă în acid dicromic, H2Cr2O7, prin protonarea totală:
- [Cr2O7]2− + 2H+
 H2Cr2O7
H2Cr2O7  H2CrO4 + CrO3
H2CrO4 + CrO3
Ionul dicromat poate fi obținut și prin reacția trioxidului de crom și acid cromic.
Referințe
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. de Gruyter, Berlin 2007, p. 1568, ISBN 978-3-11-017770-1
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.